Článek je zveřejněn v časopise Přírodní komunikace. Téměř dvoudoměrný DNA závit je umístěn v malých jádrech lidské buňky v důsledku skutečnosti, že chromatin, komplex DNA a proteiny, se otočí do kompaktních, ale složitých konstrukcí. Pro studium metod obalové DNA, vědci po celém světě používají tzv. Shoda konformace chromozomů (3C) a jedním z nejproduktivnějších z nich je metoda Hi-C. To vám umožní detekovat kontakty DNA celého genomu pomocí vysoce výkonných sekvenování.
V tom je však problém: práce hi-c vyžaduje desítky mikrogramů DNA - to znamená, že miliony buněk s unikátní organizace územního chromatinu. Tyto informace musí zprůměruje za účelem získání společného obrazu, který nebere v úvahu vlastnosti balení DNA v jednotlivých buňkách.
Stejně jako "průměrný člověk" ve skutečnosti neexistuje, tradiční metoda HI-C nemůže prokázat, která z více interakcí DNA sekcí se vyskytuje současně ve stejné buňce. Kromě toho tento "kolektivní portrét" sotva pomáhá pochopit, jaké fyzikální procesy vedou k tvorbě trojrozměrné struktury chromatinu.
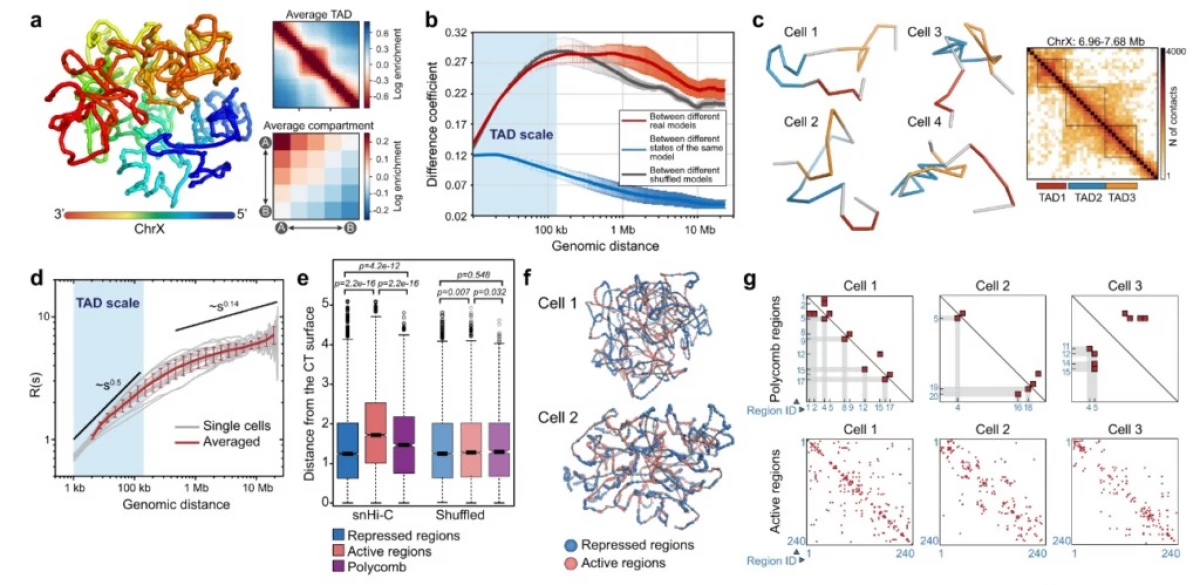
"Vidíme některé struktury, například takzvané topologicky přidružené domény (Tadada), v průměraném kontaktních karet DNA, ale nevíte, zda existují v jednotlivých buňkách, nebo to jsou artefakty průměrování. Kromě toho víme, že z hlediska genové exprese se vyskytuje široká odrůda i v buňkách stejné tkáně - odtud existuje přirozená otázka o tom, jak rozmanité jsou ve strukturální úrovni, "říká \ t Autor Mikhail Gelfand, viceprezident Scolatha podle biomedicínského výzkumu.
Chcete-li tyto problémy vyřešit a proveďte experiment Hi-C vhodnější pro jednotlivé buňky, výzkumníci několika institucí vyvinuly metodu nazvaný Hi-C jedno buňky. Skoltech Team vedený Gelfandem a docentem Centra pro život Life Scoop Catherine kostel dodal úkol pro optimalizaci zpracování dat pro jednotlivé buňky Hi-C a prozkoumat základní vlastnosti buněk Drosophila.
Jejich kolegové z biologického institutu biologie biologie Ruské akademie věd a Moskevské státní univerzitě pojmenované po MV Lomonosov, spolu se zaměstnanci rusko-francouzského interdisciplinárního vědeckého centra Poncele, optimalizoval způsob, jak je vhodné pro experimenty s droskophila buňkami .
Týmy začaly se standardními kroky metody HI-C, ve kterých je struktura chromatinu fixovaná chemicky, a DNA je řezána a "montážní" tak, že fragmenty, které jsou v přírodních podmínkách blízko, se ukázaly být "šité ". Ale pak namísto použití všech DNA najednou, vědci amplifikovali drobné množství DNA z každé buňky za použití phi29 bakteriofágu polymerázy. Tato polymeráza se často používá při zesílení DNA, částečně díky své schopnosti vytvořit velké množství DNA i na velmi malém vzorku s mnohem menším počtem chyb než ostatní populární polymerázy.
Ukázalo se však, že tato výhodná DNA polymeráza, navzdory poměrně vysoké přesnosti kopírování, může stále "skok" mezi molekuly DNA, vytvářet umělé vazby, které nelze rozlišit algoritmus Hi-C. Výzkumníci proto museli přijít s mechanismem pro odmítnutí těchto náhodných "skoků" polymerázy.
Použili svou novou metodu na Drosophila buňkách, aby zjistili, zda mají různé organismy společné základní principy chromatinu balení. Předchozí studie na savčích buňkách ukázaly existenci CZADE pouze na kontaktních kartách získaných obyvatelstvem Hi-C, ale ne v jednotlivých buňkách. Studie buněk Drosophila však ukázalo, že tyto domény jsou v každé specifické buňce.
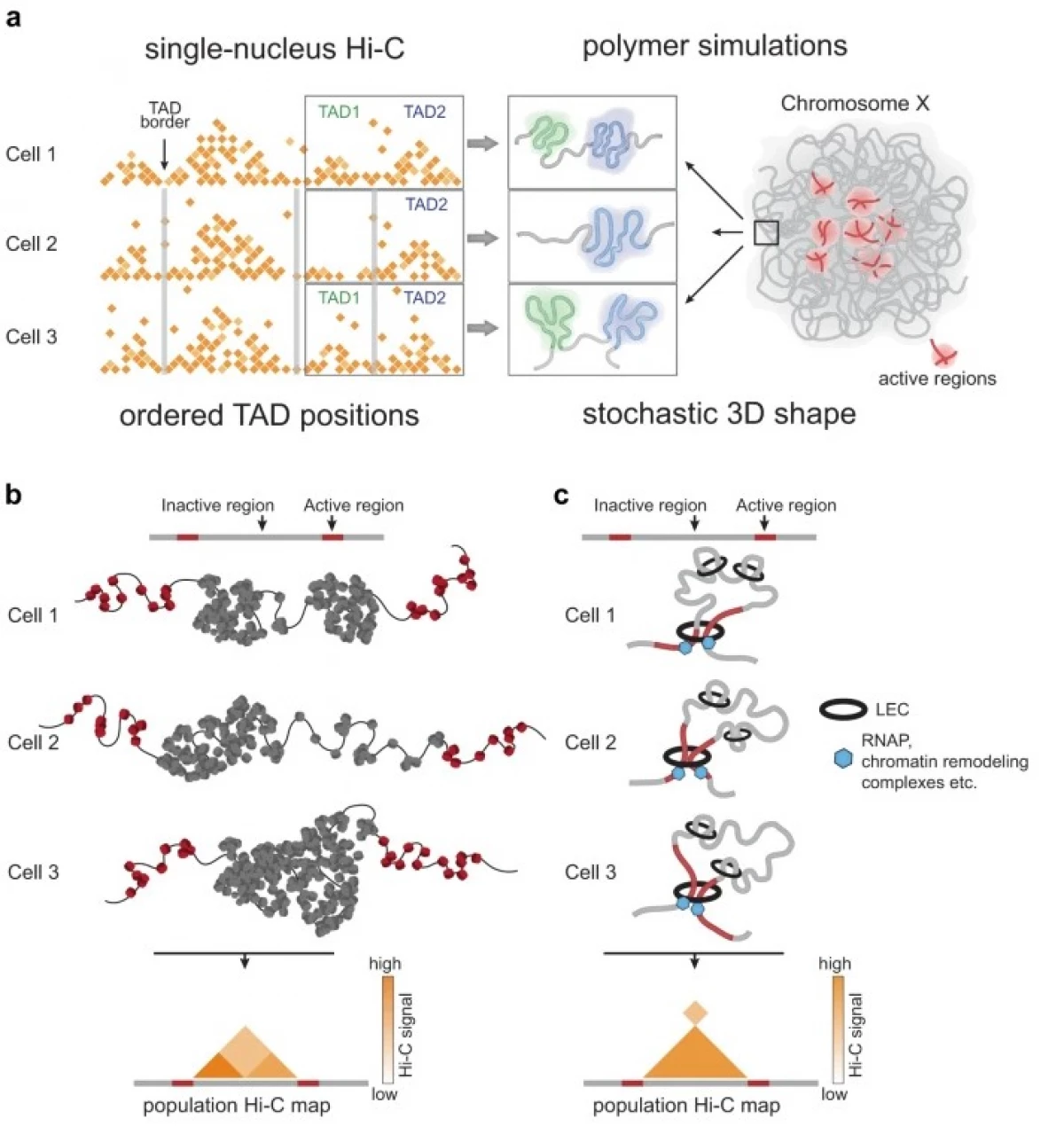
Abychom pochopili, který biologický mechanismus je zodpovědný za tvorbu těchto udržitelných domén, bude vyžadován další výzkum; Zatímco vědci nabídli dva modely jejich výskytu. Jeden z nich naznačuje, že chromatin v Drosophila je organizován mechanismem "lepkavosti", to znamená, že některé z jeho sekcí budou s větší pravděpodobností spojeny. Podle druhého, popisu tzv. Klouzavého vytlačovacího mechanismu, velké proteinové komplexy vytvářejí smyčky z nití DNA a díky tomuto balení DNA.
"Snad jedním z nejzajímavějších otázek je, zda pravidla skládacích chromatinu jsou stejné v různých typech živých organismů. Použitím metody Hi-C jedno buněk, Drozofils, zjistili jsme, že domény podobné doménám v savčích buňkách jsou také přítomny v genomu tohoto hmyzu. Tyto struktury jsou však mnohem více uspořádány než u savců, "řekl Alexander Galitsyn, Scholtech postgraduální student a jeden z prvních autorů článku.
"Budeme i nadále studovat architekturu chromatinu a mechanismů pro tvorbu smyček a Tadov. V této oblasti je stále mnoho otázek. Již víme, že tyto mechanismy v některých organismech se mohou lišit, ale jaký je vývoj chrómatin skládání jako celku? Chceme-li to pochopit na dostatečnou úroveň detailu, musíme zaplnit mezery, studovat strukturu chromatinu v podivných organismech, a ne jen ty, které jsou již dobře zkoumány. Proto již pracujeme s mořskými houbami, kvasinkami a amoebasem, "říká Catherine temmeva.
Podle ní je skupina také zapojena do možného spojení změn v organizaci chromatinu s onemocněním, vývojem těla a stárnutí. "Pokud předpokládáme, že architektura chromatiny úzce souvisí s vyjádřením genů, reaguje na tyto otázky, budeme schopni se vypořádat s regulacím rozvoji lidského těla, stárnutí a nemocí," říká Tehraeva.
Specialisté na Institutu biologie Gena Ruské akademie věd, Moskevské státní univerzity pojmenované po M. V. Lomonosově, Národním centru pro vědecký výzkum Francie, rusko-francouzského interdisciplinárního vědeckého centra Poncele a další organizace jsou zapojeny do studie.
Zdroj: Nahá věda
